Introdução
O Extra Graft XG-13 é um substituto ósseo constituído por 75% de hidroxiapatita, principal componente mineral do osso, associado à 25% de colágeno tipo I, ambos de origem bovina.
Os grânulos de hidroxiapatita apresentam propriedades físico-químicas semelhantes à estrutura óssea humana e conferem potencial osteocondutor para a regeneração óssea. O colágeno, polímero natural da matriz extracelular, tem sido utilizado em estudos de desenvolvimento de materiais para engenharia tecidual, pois é facilmente absorvido pelo corpo, permite fixação das células e é biocompatível (1,2). O Extra Graft XG-13 é produzido através de rigoroso processo de purificação de múltiplas etapas. A associação do colágeno com a hidroxiapatita forma um compósito que, além de altamente eficaz, não apresenta grau de citotoxicidade ou relato de reações adversas (3-7). Adicionalmente, por ser um material facilmente moldável, flexível e com alta agregação ao defeito ósseo, o Extra Graft XG-13 possui excelente aplicabilidade clínica (8). Dessa forma, possui estrutura física e química compatível com a aplicação como substituto ósseo.
O objetivo desta matéria é mostrar a versatilidade e segurança do substituto ósseo Extra Graft XG-13, em diferentes tipos de situações clínicas como preservação alveolar, preenchimentos de GAP e pequenos defeitos em regenerações ósseas guiadas (ROG).
Relato dos Casos
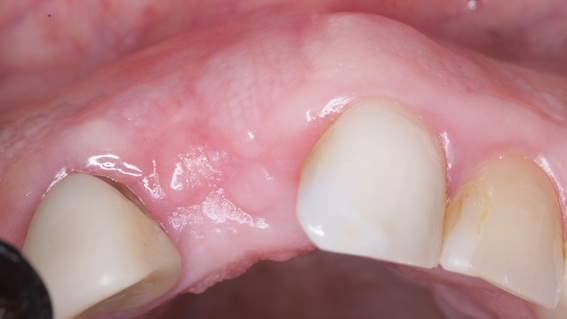
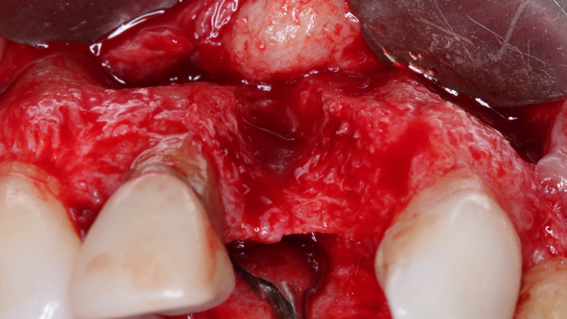
Caso 1: Preservação Alveolar em 120 dias pós exodontia com Extra Graft XG-13 e membrana de PTFE-d Cytoplast TXT 200
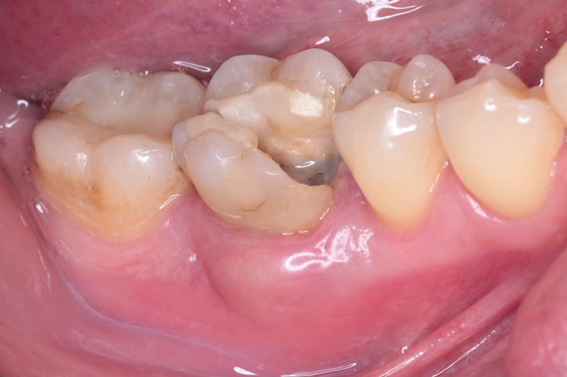
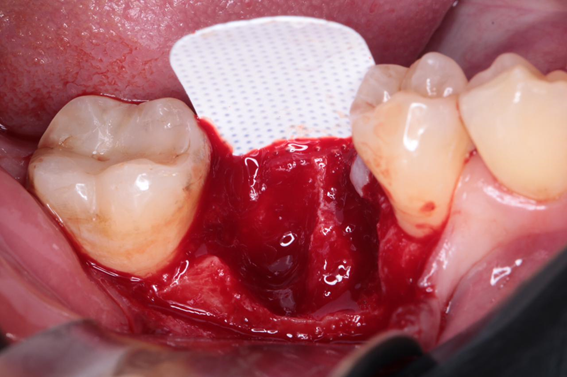


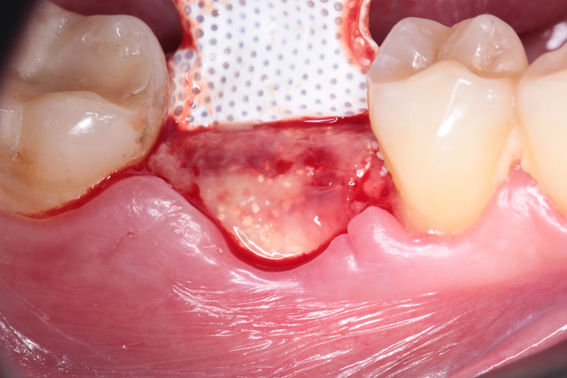
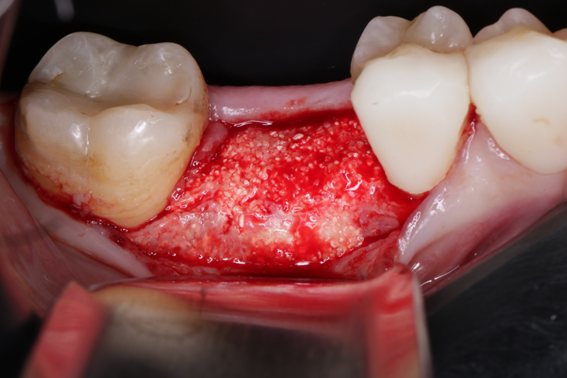
Caso 2: Preenchimento de GAP no espaço entre a parede do implante e a tábua óssea vestibular com Extra Graft XG-13
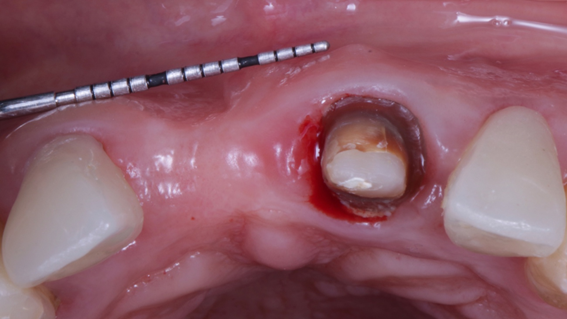
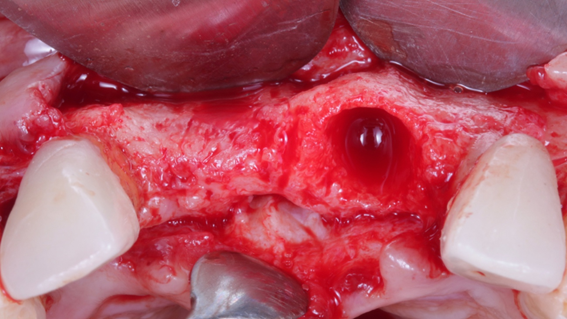
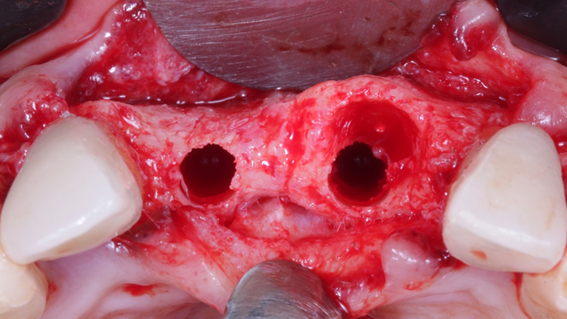

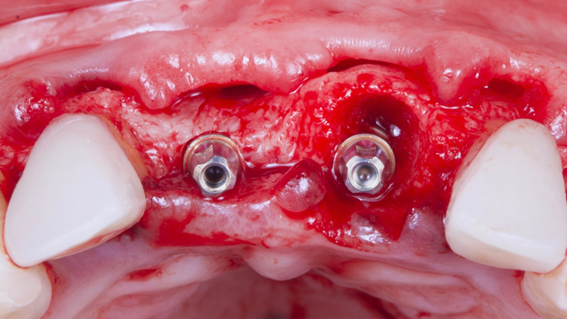
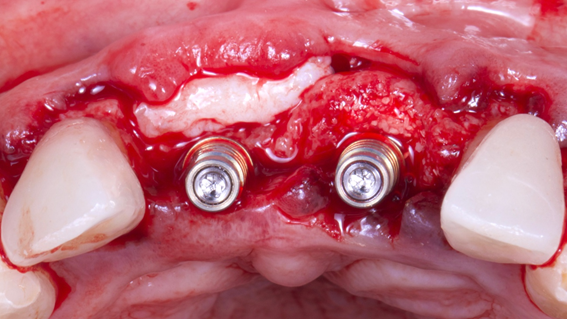
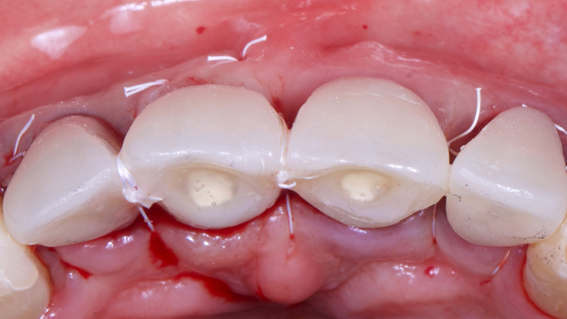
Caso 3: Regeneração Óssea Guiada (ROG) com Extra Graft XG-13 e membrana de PTFE-d Cytoplast RPM
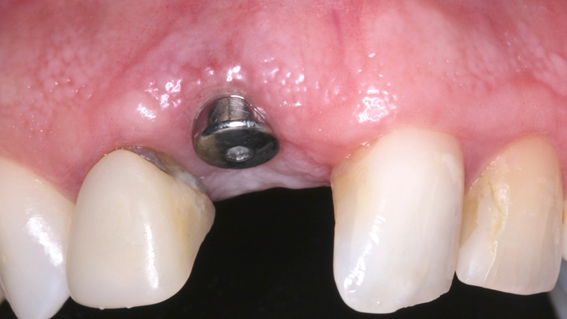
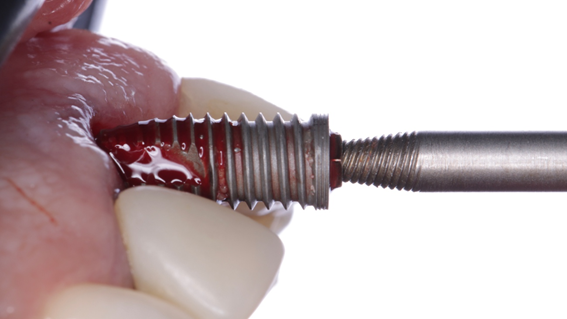




Características e benefícios
- Redução do tempo cirúrgico: fácil manipulação e adaptação ao defeito ósseo;
- Redução do desperdício de material: a presença de colágeno minimiza a dispersão da hidroxiapatita da cavidade, facilitando a inserção do produto no leito cirúrgico;
- Osteocondução: as partículas de hidroxiapatita são capazes de conduzir o desenvolvimento de novo tecido ósseo através de sua matriz de suporte (1-3);
- Vascularização: o colágeno tipo I de sua composição possui estrutura tridimensional que promove revascularização;
- Ganho de volume: os grânulos de hidroxiapatita são de lenta reabsorção, o que mantém o volume ósseo durante a remodelação tecidual fisiológica (1,6,8);
- Hemostasia: as propriedades hemostáticas do colágeno tipo I promovem estabilização do coágulo.
Conclusão
Nesta matéria foram apresentados três estudos de casos utilizando o biomaterial Extra Graft XG-13. Em todas as aplicações, tais qualidades tornam o Extra Graft XG-13 uma opção eficaz, segura e simples para a realização em diferentes procedimentos cirúrgicos, com boa adaptação nas áreas a serem enxertadas.
REFERÊNCIAS:
1- VIDAL, B. de C. The use of a complex of collagen type I with hydroxyapatite from bone, as a bone implant substitute: an experimental approach. Tissue Engineering, v.2, n. 2, p. 151-160, 1996.
2- WAHL, D. A.; CZERNUSZKA, J. T. Collagen-hydroxyapatite composites for hard tissue repair. European Cells and Materials, v. 28, p. 43-56, 2006.
3- RODRIGUES, C. V. M.; SERRICELLA, P.; LINHARES, A. B. R.; GUERDES, R. M.; BOROJEVIC, R.; ROSSI, M. A.; DUARTE, M. E. L.; FARINA, M. Characterization of a bovine collagen-hydroxyapatite composite scaffold for bone tissue engineering. Biomaterials, v. 24, n. 27, p. 4987-4997, 2003.
4- BITTENCOURT, R. C.; CASTRO-SILVA, I. I., PAULO, A. O.; TAVARES, D. S.; GRANJEIRO, J. M. Preclinical evaluation of a xenogenic hydroxyapatite/collagen-based bone substitute material. Revista Odonto Ciencia, v. 29, n. 1, p. 6-13, 2014.
5- ANTUNES, K. B.; PESSOA, V. A. A.; ZIMMERMANN, D.; MACHADO, J. J.; NICOLA, M. H. A. Diferenciação in vitro de células-tronco adiposas mesenquimais em osteoblastos: influência dos biomateriais. Implante News Perio, v. 5, n. 1, p. 315-324, 2020.
6- GEHRKE, S. A.; ARAMBURU JR., J.; TREICHEL, T. L. E.; RODRIGUEZ, F.; AZA, P. N.; DEDAVID, B. A. Comparative evaluation of two collagen-based biomaterials with different compositions used for bone graft: an experimental animal study. Journal of Applied Biomaterials & Functional Materials, v. 20, 2022.
7- HSU, F. Y.; CHUEH, S. C.; WANG, Y. J. Microspheres of hydroxyapatite/reconstituted collagen as supports for osteoblast cell growth. Biomaterials, v. 20, p. 1931-6, 1999.
8- DANTAS, A. K.; TUCCI, R.; LIMA, A. D.; TSUKUMO, S.; ABLA, M. Avaliação histológica de hidroxiapatita com colágeno quatro e dez meses após levantamento de seio maxilar. Revista ImplantNews, v. 7, n. 5, p. 647-652, 2010.




